Metal alcalino
Os Alcalinos são os elementos do Grupo 1 (1A) da Tabela Periódica, constituindo uma família ou uma série química. Formada pelos seguintesmetais: lítio (Li), sódio (Na), potássio (K) , rubídio (Rb), césio (Cs) e frâncio (Fr). Têm este nome porque reagem muito facilmente com a água e, quando isso ocorre, formam hidróxidos (substâncias básicas ou alcalinas), liberando hidrogênio. Estes metais também reagem facilmente com o oxigênio produzindo óxidos. Equação química da reacção de um metal alcalino (exemplo: lítio) com a água: Equação química da reacção de um metal alcalino (exemplo: potássio) com o oxigênio: São metais de baixa densidade, e moles. Altamente eletropositivos e reativos. A eletropositividade e a reatividade destes elementos tende a crescer, no grupo, de cima para baixo se visto do ponto de vista termodinâmico (liberação de energia), pois quanto menor, mais o elemento se hidrata, oxidando mais rápido e reagindo mais rápido, se visto do ponto de vista cinético (velocidade da reação)a reatividade tende a crescer de cima para baixo, pois quanto maior os átomos mais fácil de perder o seu elétron de valência e mais rápido reage. Apresentam um único elétron nos seus níveis de energia mais externos ( em subnível s ) , tendendo a perdê-lo, transformando-se em íons monopositivos: M+.Metal alcalino
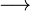 2 LiOH(aq) + H2(g)
2 LiOH(aq) + H2(g)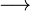 2 K2O(s)
2 K2O(s)
O hidrogênio, com um único elétron, está situado normalmente na tabela periódica no mesmo grupo dos metais alcalinos (ainda que as vezes apareca separado destes em outra posição). Porém, a energia necessária para arrancar o elétron do hidrogênio é muito mais elevada do que a qualquer alcalino. Como nos halogênios o hidrogênio necessita receber um único elétron para completar o seu nível mais externo. Na sua forma elementar é encontrado como uma molécula diatômica, H2. Pode formar sais denominados hidretos (MH) com os alcalinos, de forma que o metal cede um elétron ao hidrogênio, como se o hidrogênio fosse um halogênio. Devido a peculiaridade do hidrogênio prefere-se não classificar o hidrogênio em nenhuma série química.
